赵蕴杰教授课题组在软物质物理应用方面取得重要进展
作者:物理科学与技术学院 时间:2021-12-12 点击数:
近日,我院赵蕴杰教授课题组在HIV病毒蛋白Tat的降解机制研究中取得了重要进展,相关研究成果作为封面论文刊登于国际权威学术期刊Biophysical Journal(详见DOI: https://doi.org/10.1016/j.bpj.2021.11.006)。该论文的第一完成单位为华中师范大学物理科学与技术学院,第一作者是我校物理科学与技术学院的博士研究生宁尚波,第二作者为我校数物直博班的直博生曾成伟,赵蕴杰教授为该论文的通讯作者。
人类免疫缺陷病毒(HIV)是一种攻击宿主免疫系统的反转录病毒。截止至2019年,全球约有38万HIV病人,其中约有8万人为潜伏期患者。由于潜伏期患者并不会表现出明显的症状,其周围的人群也将处于潜在的威胁之中。因此,HIV的潜伏期机理研究和抑制剂筛选是HIV疾病诊断治疗的重要挑战。
HIV病毒蛋白Tat需要利用宿主中的P-TEFb蛋白复合物和反式作用元件(TAR)RNA调控转录的延伸。因此,病毒蛋白Tat与TAR RNA及P-TEFb复合物间的相互作用是否稳定对该病毒的转录复制十分重要。现有的研究大多数聚焦于Tat与P-TEFb复合物相互作用对病毒转录进程的影响,TAR RNA 相关的HIV转录及潜伏期机理的研究十分有限。无法精确定量计算并预测病毒Tat与宿主蛋白相互作用的微小变化是目前理论研究的瓶颈问题。
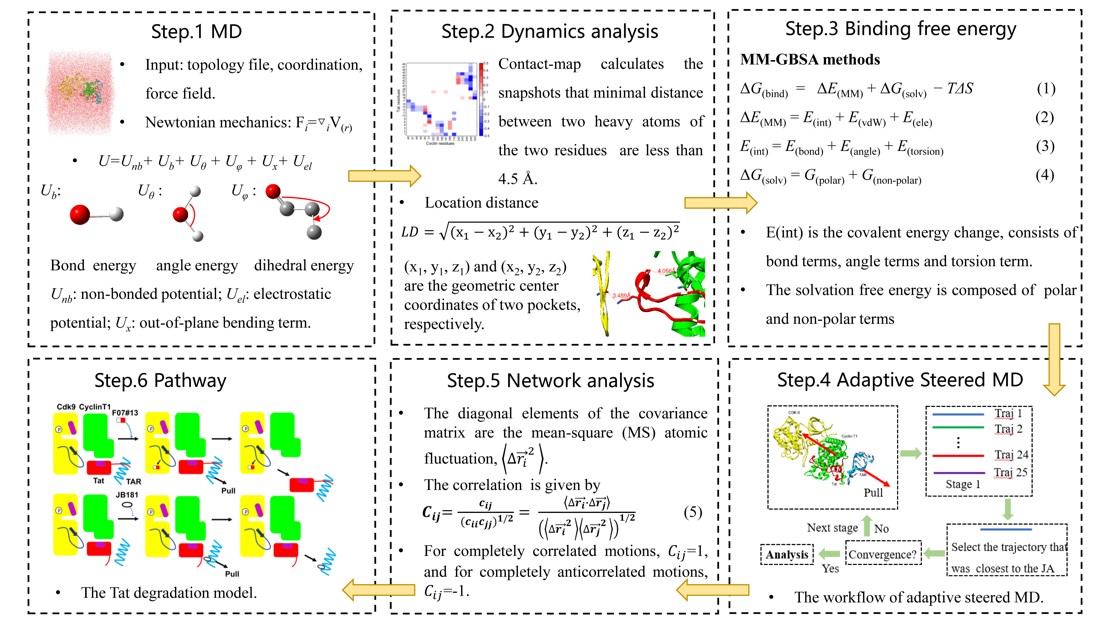
针对以上挑战,赵蕴杰教授课题组于2020年发展了基于分子动力学模拟的动态网络分析模型,该方法可以定量计算复合物间多体相互作用的微小变化。结果表明,病毒蛋白Tat突变产生的相互作用变化的理论预测与实验结果一致,解释了HIV病毒Tat突变导致的潜伏期机理,该工作以封面论文发表于Physical Chemistry Chemical Physics (2020,44: 25474-25482)。在此工作的基础上,课题组进一步发展了全原子增强采样模型预测抑制剂对病毒蛋白Tat降解产生的影响。动力学网络分析可以定量计算病毒Tat与宿主蛋白之间的微小相互作用变化,基于增强采样的拉伸动力学可以扩大并预测抑制剂对复合物体系的影响。结果表明,蛋白靶向抑制剂可以破坏Tat/P-TEFb间的相互作用,促进Tat从复合物解离并被降解。反之,RNA靶向抑制剂可以抑制Tat与P-TEFb之间的解离,减少Tat的降解。两种靶向抑制剂的理论预测结果均与实验结果完全一致。该研究工作为人类免疫缺陷病毒潜伏期问题的机理研究,开发相关的靶向药物提供了新的思路。
上述研究得到了国家自然科学基金, 湖北省自然科学基金,中央高校基本科研业务经费等项目的资助。
